- Типы злокачественности
- Причины развития
- Проявления и симптомы
- Диагностика
- Возможности лечения
- Факторы прогноза
GI стромальные опухоли (ГИСО) представляют собой новообразования с различным потенциалом злокачественности, от практически индолентных (низкой степени злокачественности) опухолей до быстро прогрессирующих злокачественных новообразований. ГИСО встречаются по всему кишечному тракту, и большинство из них содержат активирующую мутацию в KIT или тромбоцитарном факторе роста A (PDGFRA). Диагноз ставится с помощью иммуногистохимии, но молекулярный анализ с мутационным анализом имеет первостепенное значение для выбора соответствующей терапии.
Приблизительно 50-70% ГИСО происходят из желудка. Тонкая кишка становится вторым, наиболее распространенным местом, с 20-30% ГИСО. Менее частые места возникновения включают толстую кишку, прямую кишку (5-15%) и пищевод (<5%).
Отдаленные метастазы появляются поздно в большинстве случаев. В отличие от других опухолей мягких тканей, общими метастатическими участками ГИСО становятся печень и брюшина. Средний возраст при постановке диагноза — от 50 до 60 лет.
Классификация
Классификация на основе гистологической оценки клеточного состава опухоли свойственной неклассифицированным саркомам мягких тканей (эпителиоидные, веретеноклеточные и т.д.) сейчас неактуальна.
Вместо гистологической оценки ГИСО используется показатель митотического индекса.
Гастроинтестинальные стромальные опухоли принято делить в соответствии уровнем агрессивности на три подтипа:
- доброкачественные/индолентные;
- неопределенного злокачественного потенциала;
- злокачественные.
Отнесение конкретной опухоли к тому или иному подтипу выполняется путем комплексной оценки четырех показателей.
- Размер опухоли. Большие опухоли более склонны вести себя агрессивно, чем маленькие опухоли. Небольшая ГИСО с размером менее 2 см, может не вызвать проблем в будущем.
- Митотический индекс. Митотический счет — это количество активно делящихся клеток, видимых под микроскопом в заданной области опухоли. Оно говорит врачам о скорости размножения раковых клеток и служит показателем агрессивности опухоли. Низким считается индекс ≤ 5/50, что соответствует 5 видимым делениям в поле 5 мм².
- Место расположения. Опухоли в тонкой кишке и прямой кишке более агрессивны, чем опухоли в желудке.
- Разрыв опухоли. Если поверхность опухоли была повреждена во время операции по ее удалению или если опухоль не была интактной во время операции, существует вероятность того, что опухолевые клетки могли проникнуть в брюшную полость. Иногда это само по себе определяет опухоль как высокий риск.
Что такое гастроинтестинальные стромальные опухоли
Гастроинтестинальная стромальная опухоль (ГИСО, GIST) — мезенхимальное образование злокачественной природы. Имеется предположение, что она развивается из клеток Кахала или их предшественников.
Такая опухоль имеет сходство с гладкомышечными и нейрогенными образованиями. Однако при более глубоком исследовании у нее выявляются определенные особенности, позволяющие отнести эти новообразования в отдельную группу.
Важно! Все виды ГИСО потенциально злокачественные и метастазируют преимущественно гематогенным путем.
GIST — это узел, локализованный под слизистой. Такие образования склонны расти в просвет полого органа. Насколько опухоль опасна, зависит от ее расположения, размера и скорости деления.
У ГИСО, размер которой не превышает 2-5 см, злокачественный потенциал довольно низкий, а у образований диаметром более 10 см он заметно выше.
В каждом клиническом случае подбирается своя тактика терапии GIST. Обязательным аспектом лечения является поиск мутаций в генах. При их выявлении прибегают к таргетной терапии с использованием низкомолекулярных ингибиторов тирозинкиназ и мультикиназного ингибитора. Такое лечение проводят в несколько стадий.
Причины возникновения и факторы риска
Ученые обнаружили, что клетки могут расти неконтролируемым образом в результате нарушения в их ДНК. В ГИСО специфическая мутация заставляет клеточный фермент, известный как KIT, постоянно включаться.
KIT — это фермент (из группы внутриклеточных тирозинкиназ), ответственный за передачу сигналов роста и выживания внутри клетки. Если он включен, клетка растет или размножается. Выключение этого фермента переводит клетку в состояние покоя. Гиперактивный, неконтролируемый мутантный фермент KIT запускает быстрый рост и бесконечное размножение опухолевых клеток ГИСО.
Понимание этого процесса, уже помогло определить новые методы лечения этой неоплазии.
Факторы риска для ГИСО
Нейрофиброматоз
Наиболее существенным фактором риска для ГИСО становится наличие нейрофиброматоза. Он почти всегда связан с развитием таких новообразований.
Семейный анамнез
Есть редкие случаи появления наследственных ГИСО. Наследственные опухоли характеризуются унаследованными мутациями зародышевой линии в KIT или PDGFRA и дополнительными синдромами, такими как:
- кожная гиперпигментация;
- синдром раздраженного кишечника;
- дисфагия;
- дивертикулез кишечника.
95% ГИСО — KIT-положительные. Но 5% не демонстрируют определяемой экспрессии KIT. В части этих KIT-негативных ГИСО мутации происходят в гене PDGFRA, а не в KIT. Было показано, что иммуноокрашивание с помощью PDGFRA помогает различать KIT-негативные ГИСО и другие желудочно-кишечные поражения мезенхимы.
Мутации BRAF и протеинкиназа Сθ (PKCtheta) также были зарегистрированы в небольшом количестве ГИСО без KIT/PDGFRA. Первоначальные исследования показывают, что ГИСО с мутацией BRAF имеют склонность к тонкой кишке и не связаны с высоким риском злокачественности.
Причины стромальных опухолей
В большинстве случаев гастроинтестинальные стромальные опухоли появляются спонтанно. До 85 % ГИСО имеют мутации в гене C-KIT и 3-18 % — в гене PDGFRA. В 10-15% случаев мутации в этих генах не выявляют, поэтому патологии присваивается дикий тип (WT).
Но более широкие генетические исследования доказывают, что стромальные опухоли с WT — это разнородная группа, у которой присутствует активирующая мутация ряда генов.
Справка! Гораздо реже ГИСО возникает в рамках наследственных семейных или идиопатических мультиопухолевых синдромов (триада Карнея).
Симптомы
До 75% ГИСО обнаруживаются, когда они меньше 4 см в диаметре и либо бессимптомны, либо связаны с неспецифическими симптомами. Их часто диагностируют случайно во время рентгенологических исследований или эндоскопических или хирургических процедур, выполняемых для исследования заболевания желудочно-кишечного тракта или для лечения неотложных состояний. В Японии массовый скрининг на аденокарциному желудка с помощью верхней эндоскопии привел к увеличению случайных выявлений бессимптомных ГИСО.
В популяционном исследовании средний размер опухолей ГИСО, которые были обнаружены как случайные находки, составлял 2,7 см, по сравнению с 8,9 см для тех, которые были обнаружены на основании симптомов.
Верхнее кровотечение из желудочно-кишечного тракта — наиболее распространенное клиническое проявление ГИСО. Оно отмечается у 40-65% пациентов. Пациенты, которые испытали значительную потерю крови, могут сообщать о недомогании, усталости или одышке при физической нагрузке.
Обструкция может возникать в результате внутрипросветного роста эндофитной опухоли или из-за компрессии просвета из-за экзофитного поражения. Обструктивные симптомы могут быть органоспецифическими (например, затруднение глотания при опухоли пищевода, запор при ректальной опухоли, механическая желтуха при опухоли двенадцатиперстной кишки).
Другие симптомы:
- боль в животе;
- анорексия;
- тошнота;
- рвота;
- потеря веса;
- давление в эпигастрии;
- быстрая насыщаемость.
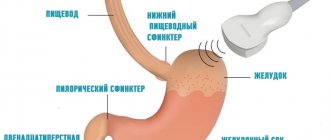
Диагностика
Диагноз выставляют с учетом клинических симптомов, данных внешнего осмотра и объективных исследований. Пациентам назначают рентгенографию органов брюшной полости, УЗИ и контрастную КТ органов брюшной полости. При низко расположенных опухолях больных направляют на МРТ. При поражении желудка осуществляют гастроскопию, при поражении толстого кишечника – колоноскопию. При подозрении на метастазирование гастроинтестинальной стромальной опухоли проводят рентгенографию грудной клетки, КТ грудной клетки, рентгенографию позвоночника, сцинтиграфию костей скелета и другие исследования. При возможности используют ПЭТ-КТ, позволяющую точно определять распространенность гастроинтестинальной стромальной опухоли и выявлять небольшие метастазы, не обнаруживаемые при помощи других методик. Окончательный диагноз устанавливают на основании гистологического и иммунохимического исследования образца ткани, взятого при проведении эндоскопического исследования.
Лечение
Таргетная терапия
Хотя хирургическая резекция является предпочтительным методом лечения желудочно-кишечных стромальных опухолей (ГИСО) и предлагает единственный шанс на полное выздоровление, главную роль в лечении играют сейчас ингибиторы тирозинкиназы(TKI). И наиболее распространенными препаратами этой группы стали — Гливек® (Gleevec®) и Сутент® (Sutent®). Иматиниб и сунитиниб соответственно.
Сейчас при устойчивости опухоли к лечению этими препаратами широко используются новые лечебные агенты, такие как регорафениб, а США и Европе — сорафениб и другие.
Стандартные показания для использования ингибиторов тирозинкиназы:
- лечение неоперабельных и/или метастатичных ГИСО;
- предоперационное лечение новообразований, которые могут стать резектабельными с отрицательным краем;
- адъювантное лечение после полной грубой резекции неоплазии, для предотвращения рецидива.
Европейское сообщество медицинской онкологии (ESMO) рекомендует, чтобы оценка ответной реакции на лечение была сложной и что раннее прогрессирование, в частности, должно подтверждаться опытной командой. В большинстве случаев на противоопухолевую активность указывает уменьшение опухоли. Но иногда ответ опухоли определяется только уменьшением ее плотности. Или снижение плотности (с увеличением размера!) может предшествовать последующему уменьшению опухоли.
По данным ESMO, отсутствие прогрессирования опухоли через 6 месяцев лечения также является ответом опухоли.
Хирургическое лечение
До недавнего времени единственным методом лечения ГИСО была операция. Цель операции — полностью удалить опухоль. Однако одна только операция для больших или распространившихся новообразования, дает неутешительные результаты.
Хирургия осталась окончательной терапией для четко локализованных ГИСО. Несмотря на доказанный успех иматиниба и других более новых ингибиторов тирозинкиназы, хирургическая резекция остается выбором выбора и предлагает единственный шанс на полное избавление от ГИСО.
Учитывая способность иматиниба превращать неоперабельные опухоли в частично операбельные, может быть использована циторедуктивная хирургия — удаление максимально-возможного объема опухоли с целью достижения неполной ремиссии. Пациент получает неоадъювантную терапию в течение 6 месяцев, а затем проводится широкая резекция. Это нередко обеспечивает существенное увеличение выживаемости.
Лечение гастроинтестинальных стромальных опухолей
При четкой, нерассеянной локализации гастроинтестинальных стромальных опухолей лечение начинают с хирургического вмешательства. При нерезектабельных образованиях, возобновлении болезни после ремиссии или при наличии метастазов отдают предпочтение таргетной терапии.
Локализованные формы
При новообразованиях малых размеров (менее 1-2 см), если позволяет клиническая ситуация, оправдано наблюдение за пациентом в динамике.
Однако, отказавшись от активной хирургической тактики, необходимо учитывать потенциальный риск прогрессирования патологии, опираясь на гистологические исследования. Если образовании более 2 см, то показано радикальное вмешательство.
Нюансы терапии с применением хирургических методов:
- При расположении опухоли в пищеводе, входном отделе желудка, 12-перстной или прямой кишке, перед резекцией рекомендована терапия, позволяющая уменьшить ее размеры. А затем выполняют операцию с сохранением органа.
- Если есть сомнения относительно операбельности опухоли, то перед запланированным радикальным вмешательством рекомендовано на протяжении 6-12 месяцев принимать иматиниб.
- За пациентами с низким риском прогрессирования патологии, после хирургического вмешательства осуществляют динамическое наблюдение. Если риск высокий или промежуточный, то прибегают к лекарственной терапии иматинибом на протяжении 1-3 лет.
После полного курса адъювантной терапии, в случае рецидива болезни, снова возобновляют прием иматиниба.
Диссеминированные опухоли и другие случаи
При диссеминированных случаях ГИСО или при отсутствии возможности выполнить резекцию, последовательно проводят 3 линии таргетной терапии:
- Иматиниб — это препарат первой линии. Он представляет собой низкомолекулярный ингибитор ряда рецепторных (с-KIT, PDGFRα) и не рецепторных тирозинкиназ (Abl, Bcr-Abl). Не исключено развитие первичной или вторичной резистентности к этому веществу.
- Сунитиниб — это препарат второй линии. Он относится к низкомолекулярным ингибиторам различных (более 80) тирозинкиназ. Однако из-за выраженной токсичности некоторые больные прерывают лечение этим веществом.
- Регорафениб — это препарат третьей линии. Это пероральный мультитаргетный (мультикиназный) ингибитор, действующий на тирозинкиназы, ангиогенез и микроокружения опухоли. Регорафениб назначается пациентам, которые были вынуждены прекратить прием сунитиниба из-за его непереносимости.
В большинстве рассеянных случаев ГИСО развивается устойчивость к иматинибу и сунитинибу, на фоне которой болезнь начинает динамично прогрессировать.
Регорафениб — это основное решение проблемы, если первые 2 препарата перестают себя оправдывать. Благодаря этому больные получают продолжительную, успешную терапию.
Обычно лечение начинают с применения иматиниба, постепенно заменяя дозировку 400 мг на 800 мг в сутки. На следующем этапе переходят к сунитинибу и лишь затем к регорафенибу.
Однако, при повышенной чувствительности к сунитинибу, уже во второй линии возможно применение регорафениба, оказывающего меньшую токсичность на организм.
Преимущества лечения в Бельгии
- Доступность новейших препаратов. В Бельгии при резистентности опухоли к терапии иматинибом, сунитинибом и регорафенибом у больного есть возможность получить лечение новыми препаратами — сорафенибом, дасатинибом и нилатанибом. Это помогает продлевать жизнь даже в самых сложных случаях.
- Лапароскопическая малоинвазивная хирургия. Она используется в Бельгии при новообразованиях, не превышающих 5 см, расположенных в желудке и тонкой кишке. Преимущества лапароскопической резекции включают более быстрое возобновление нормального питания, более короткое пребывание в стационаре после операции и меньшее использование анальгезии. Краткосрочные результаты при этом остаются такими же, как и при открытой операции.
- Стоимость лечения. Она в Бельгии примерно на 30% ниже, чем в соседних странах Европы и на 60% ниже, чем в США. С учетом высокой стоимости лекарств, этот факт приобретает особую важность.
Симптомы гастроинтестинальных стромальных опухолей
GIST не имеет специфических проявлений. На ранних стадиях у большинства стромальных опухолей симптомы отсутствуют. Даже довольно большие образования данного типа часто никак не дают о себе знать.
Но со временем, как и при других злокачественных опухолях ЖКТ, у пациентов появляются: абдоминальные боли, тошнота, беспричинная потеря веса, повышенная утомляемость.
На слизистой оболочке, под которой находится опухоль, может появиться язва, провоцирующая скрытое или массивное кровотечение в ЖКТ. Это приводит к развитию гематологического синдрома, характеризующегося нарушением синтеза гемоглобина на фоне недостатка железа.
Опухоль желудка, локализованная в области антрума, может спровоцировать патологическое сужение выходного отдела этого органа.
Гастроинтестинальная стромальная опухоль (ГИСО) (gastrointestinal stromal tumors — GIST) как самостоятельное заболевание описана 20 лет назад. ГИСО является самой распространенной мезенхимальной опухолью желудочно-кишечного тракта, частота ее выявления достигает 15 на 1 млн населения в год [1,2,21]. Чаще ГИСО возникает в желудке, где выявляется до 60-70% этих новообразований [4, 5, 10, 13, 14, 23]. ГИСО развиваются из клеток Кахаля, которые являются пейсмекерными клетками желудочно-кишечного тракта [20]. Дифференциальная диагностика с другими неэпителиальными опухолями желудочно-кишечного тракта основывается на иммуногистохимическом исследовании. Для этих опухолей характерны положительные реакции c маркерами CD117, CD34, гладкомышечным актином, десмином и S100 [6].
Широкое клиническое применение иматиниба мезилата («Гливек») изменило тактику лечении больных и привело к пересмотру показаний к оперативному лечению ГИСО [8]. Однако радикальное хирургическое удаление первичной опухоли до сих пор рассматривается как наиболее предпочтительный вариант лечения [3,7].
С июля 2005 г. по сентябрь 2010 г. в Институте хирургии им. А.В. Вишневского проходило обследование и лечение 34 больных с морфологически верифицированными ГИСО. Опухоли локализовались в желудке у 17 (53,1%) из них, в двенадцатиперстной кишке — у 10 (31,3%) и тонкой кишке — у 5 (15,6%) пациентов. Размер первичных новообразований колебался в широких пределах и в среднем составил 6,7±5,4 см.
Приводим наблюдение лечения гигантской ГИСО желудка.
Больная К.,
70 лет, 06.07.10 поступила в отделение абдоминальной хирургии №1 Института хирургии им. А.В. Вишневского с жалобами на боли и чувство тяжести в эпигастральной области, наличие опухолевидного образования в животе, похудание на 6 кг за год.
Из анамнеза известно, что пациентку в течение года беспокоили периодически возникающие боли в эпигастральной области. За полгода до поступления больная самостоятельно обнаружила у себя опухолевидное образование брюшной полости. При компьютерной томографии, выполненной амбулаторно, выявлена опухоль брюшной полости неоднородной структуры, размером 24,5×22,5×14,4 см.
При поступлении состояние больной удовлетворительное, кожа естественной окраски, чистая. В легких везикулярное дыхание, проводится симметрично, хрипов нет. Тоны сердца звучные, ритмичные. АД 130/75 мм рт.ст. Пульс 72 в 1 мин. Живот не вздут, участвует в дыхании всеми отделами, деформирован за счет наличия опухоли диаметром около 30 см. При пальпации опухоль каменистой плотности, безболезненна, незначительно смещается. Перистальтика обычная. Стул регулярный. Ректально патологических изменений не выявлено. Дизурические явления отсутствуют.
В общих анализах крови и мочи, при биохимическом исследовании крови отклонений от нормы нет.
При УЗИ в брюшной полости визуализируется округлой формы кистозное образование с четкими неровными контурами. По внутренней поверхности определяются солидные мягкотканные структуры по типу выростов. Стенка образования представляется слоистой, неравномерно утолщенной до 13 мм. Образование смещает петли кишечника кзади, головку поджелудочной железы — книзу. Пиелоэктазии нет.
По данным 256-мультидетекторной спиральной компьютерной томографии органов брюшной полости свободной и осумкованной жидкости не выявлено. От нижней поверхности печени до апертуры таза визуализируется опухолевидное образование с четкими контурами, неправильной овальной формы, размером 30×32×28 см (рис. 1, а).
Рисунок 1. Мультидетекторная спиральная компьютерная томография органов брюшной полости. а — артериальная фаза исследования. Опухоль с четкими контурами, овальной формы, размером до 32 см. 1 — опухоль, 2 — желудок, 3 — двенадцатиперстная кишка. Структура образования неоднородна: на фоне мягкотканного компонента визуализируются гиподенсные участки. При контрастном усилении видна капсула толщиной 3 мм, неравномерно накапливающая контрастное вещество. Мягкотканные структуры также накапливают контрастный препарат. Образование прилежит медиальным контуром к выходному отделу желудка. Желудок увеличен в размерах, растянут жидкостью. Жировая прослойка между выявленным образованием и стенкой выходного отдела желудка не прослеживается. Задняя поверхность образования прилежит к головке и перешейку поджелудочной железы, оттесняя их книзу, признаков прорастания в железу нет. Двенадцатиперстная кишка распластана на опухоли. Желчный пузырь, петли тонкой кишки оттеснены, но прорастания в них опухоли нет. Левая и правая печеночные артерии проходят по контуру образования, в опухоль не вовлечены. Общая печеночная артерия, селезеночная артерия, правая и левая ветви воротной вена, селезеночная вена интактны (рис. 1, б).
Рисунок 1. Мультидетекторная спиральная компьютерная томография органов брюшной полости. б — структура образования неоднородна: на фоне мягкотканного компонента визуализируются гиподенсные участки. Таким образом, выявленное образование соответствует ГИСО желудка или забрюшинной опухоли.
При магнитно-резонансной томографии в брюшной полости также определяется образование размером до 31,5 см с неровными четкими контурами, капсулой толщиной до 3 мм. Петли тонкой и толстой кишки смешены и раздвинуты образованием. Желудок в выходном отделе смещен и сдавлен опухолью. Картина неорганной забрюшинной опухоли смешанного строения представлена на рис. 2.
Рисунок 2. Магнитнорезонансная томография. Опухоль неоднородной структуры, занимает большую часть брюшной полости.
При эзофагогастродуоденоскопии определяется деформация тела и антрального отдела желудка за счет компрессии извне. Изъязвлений слизистой нет. Смешанный гастрит. Недостаточность кардии.
Рентгенологическое исследование желудка с бариевой взвесью выявило, что акт глотания не нарушен, пищевод свободно проходим, желудок в форме крючка и имеет перегиб в области свода, нижний контур желудка располагается ниже крыльев подвздошных костей на 6 см (рис. 3).
Рисунок 3. Рентгенологическое исследование верхних отделов желудочно-кишечного тракта с бариевой взвесью. Антральный отдел желудка и двенадцатиперстная кишка распластаны на опухоли. Эвакуация из желудка не нарушена. 1 — желудок, заполненный рентгеноконтрастным веществом; 2 -антральный отдел желудка и двенадцатиперстная кишка оттеснены и распластаны на опухоли. Контрастный препарат из желудка тонкой струей попадает в двенадцатиперстную кишку. Антральный отдел желудка и луковица двенадцатиперстной кишки распластаны на гигантской опухоли и оттеснены кпереди. В просвете желудка содержится незначительное количество жидкости и слизи. Рельеф слизистой не нарушен, складки утолщены, направлены параллельно малой кривизне. По большой кривизне отмечается неравномерная зазубренность. Перистальтика немного замедлена, эвакуация начинается через 2-3 мин после глотка и происходит небольшими порциями. Луковица двенадцатиперстной кишки треугольной формы с эластичными стенками. Начальные отделы тощей кишки без особенностей Рентгенологическая картина характерна для гигантского новообразования желудка, исходящего из стенки антрального отдела.
В результате обследования установлен диагноз: гигантская неэпителиальная опухоль желудка (ГИСО?), желчнокаменная болезнь: хронический калькулезный холецистит.
20.07.10 больная оперирована. Выполнена тотальная срединная лапаротомия. Брюшина гладкая, блестящая; асцита нет. Большую часть брюшной полости занимает огромная кистозная опухоль с белесоватой плотной капсулой, которая располагается кпереди от кишечника. Опухоль легко выведена из брюшной полости (рис. 4, а).
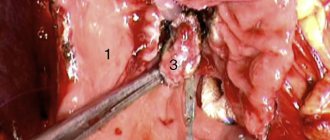
Рисунок 4. Интраоперационная картина. а — опухоль исходит из малой кривизны желудка. 1 — опухоль, 2 — желудок, распластанный на опухоли.
Сращений с прилежащими органами нет. При ревизии установлено, что печень обычного цвета и размера, метастазов не определяется. В желчном пузыре камень размером 5×2 см, воспаления пузыря нет. Петли тонкой и ободочной кишки не изменены. Опухоль исходит из малой кривизны нижней трети желудка. Двенадцатиперстная кишка распластана по правому контуру опухоли, прорастания в кишку и поджелудочную железу нет. Лимфатические узлы по ходу сосудов чревного ствола не увеличены. Матка и ее придатки не изменены. Ситуация соответствует гигантской ГИСО, исходящей из дистальной части желудка, желчнокаменной болезни. Произведена мобилизация желудка вместе с опухолью. Выполнена субтотальная дистальная резекция желудка с погружением культи двенадцатиперстной кишки в кисетный шов, прошиванием малой кривизны УО-60 и перитонизацией узловыми швами. Гастроэнтероанастомоз конец в конец в один ряд швов на Ру-петле, сформированной из тощей кишки (длина Ру-петли 60 см). Холецистэктомия с перевязкой пузырного протока и артерии. Операция завершена дренированием подпеченочного пространства.
Морфологическое исследование: опухоль диаметром 33 см, массой 5250 г (рис. 4, б).
Рисунок 4. Интраоперационная картина. б — макропрепарат удаленной опухоли. Гистологическое исследование: веретоноклеточный вариант ГИСО с эндофитным типом роста и некрозом опухоли. При иммуногистохимическом исследовании получены следующие результаты: CD117 (+++), CD34 (+++), гладкомышечный актин (-), Ki-67 составляет 2%, митозы — 2-3 в 50 полях зрения. При полимеразной цепной реакции с последующим секвенированием выявлена мутация в 11-м экзоне гена KIT, которая соответствует замене валина в положении 559 на аспарагиновую кислоту (V559D).
Послеоперационный период протекал без осложнений. В удовлетворительном состоянии больная выписана из стационара на 10-е сутки после операции.
Обсуждение
В последнее время большое количество работ посвящено определению прогноза течения заболевания и тактики лечения больных с ГИСО.
Прогноз прогрессирования болезни основывается на результатах коллективных исследований более 1000 больных, получавших лечение в клиниках Польши [19], Тайваня [11], Японии [22], клинике Мейо [9]. В качестве основных прогностических факторов выделены: размер опухоли более 10 см; нерадикальное удаление опухоли, особенно с повреждение целостности капсулы; количество митозов; мутации KIT; индекс пролиферации; наличие ядерного полиморфизма; некроз опухоли, вовлечение и изъязвление слизистой желудочно-кишечного тракта; прорастание серозной оболочки. Предложены несколько схем стратификации риска рецидива ГИСО, наиболее популярной из которых является схема, предложенная H. Joensuu [12] (см. таблицу).
Опубликованы результаты крупных мультицентровых исследований, проведенных в Швеции [18] и Модене [17], в Институте патологии вооруженных сил США [16,15]. При этом на сегодняшний день существует ограниченное количество данных по критериям определения алгоритма лечения гигантских ГИСО. Опубликован ряд работ, показывающих эффективность неоадъювантной таргетной терапии. Насколько это важно для больных, у которых выполнимо удаление гигантских ГИСО, остается неясным.
Мы считаем, что лечение гигантских ГИСО следует начинать с хирургического удаления опухоли (если это не связано с неоправданно высоким периоперационным риском) с последующим проведением таргетной терапии Гливеком. Для местно-распространенных ГИСО с инвазией в магистральные сосуды и окружающие органы целесообразно рассматривать вопрос о проведении неоадъювантной терапии.